Oleh : Arif Kurniawan
Mahasiswa FKIP Universitas Sebelas Maret
Mesin Carnot
adalah mesin kalor hipotetis yang beroperasi dalam suatu siklus reversibel yang
disebut siklus Carnot. Model dasar mesin ini dirancang olehNicolas Léonard Sadi
Carnot, seorang insinyur militer Perancis pada tahun 1824. Model mesin Carnot
kemudian dikembangkan secara grafis oleh Émile Clapeyron 1834, dan diuraikan
secara matematis oleh Rudolf Clausius pada 1850an dan 1860an. Dari pengembangan
Clausius dan Clapeyron inilah konsep dari entropi mulai muncul. Setiap sistem
termodinamika berada dalam keadaan tertentu.
Sebuah siklus
termodinamika terjadi ketika suatu sistem mengalami rangkaian keadaan-keadaan
yang berbeda, dan akhirnya kembali ke keadaan semula. Dalam proses melalui siklus
ini, sistem tersebut dapat melakukan usaha terhadap lingkungannya, sehingga
disebut mesin kalor.
Sebuah mesin kalor
bekerja dengan cara memindahkan energi dari daerah yang lebih panas ke daerah
yang lebih dingin, dan dalam prosesnya, mengubah sebagian energi menjadi usaha
mekanis. Sistem yang bekerja sebaliknya, dimana gaya eksternal yang dikerjakan
pada suatu mesin kalor dapat menyebabkan proses yang memindahkan energi panas
dari daerah yang lebih dingin ke energi panas disebut mesin refrigerator.
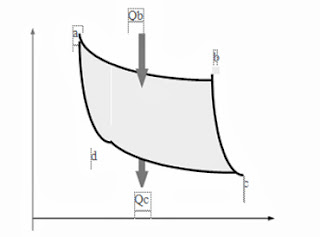
Pada diagram di
samping, yang diperoleh dari tulisan Sadi Carnot berjudul Pemikiran tentang
Daya Penggerak dari Api (Réflexions sur la Puissance Motrice du Feu),
diilustrasikan ada dua benda A dan B, yang temperaturnya dijaga selalu tetap,
dimana A memiliki temperatur lebih tinggi daripada B. Kita dapat memberikan
atau melepaskan kalor pada atau dari kedua benda ini tanpa mengubah suhunya,
dan bertindak sebagai dua reservoir kalor.
Carnot menyebut
benda A "tungku" dan benda B "kulkas".[1] Carnot lalu
menjelaskan bagaimana kita bisa memperoleh daya penggerak (usaha), dengan cara
memindahkan sejumlah tertentu kalor dari reservoir A ke B.
Siklus Carnot
Tahun
1824 Sadi Carnot menunjukkan bahwa mesin kalor terbalikkan adengan siklus
antara dua reservoir panas adalah mesin yang paling efisien.
Siklus Carnot terdiri dari proses
isotermis dan proses adiabatis.
1. Proses
a-b : ekaspansi isotermal pada temperatur Th (temperatur tinggi). Gas dalam keadaan
kontak dengan reservoir temperatur tinggi. Dalam proses ini gas menyerap kalor
Th dari reservoir dan
melakukan usaha Wab menggerakkan
piston.
2. Proses
b-c : ekaspansi adiabatik. Tidak ada kalor yang diserap maupun keluar sistem.
Selama proses temperatur gas turun dari Th ke Tc (temperatur rendah) dan melakukan
usaha Wab.
3. Proses
c-d : kompresi isotermal pada temperatur Tc (temperatur tinggi). Gas dalam keadaan
kontak dengan reservoir temperatur rendah. Dalam proses ini gas melepas kalor Qc dari reservoir dan mendapat usaha dari
luar Wcd
4. Proses
d-a : kompresi adiabatik. Tidak ada kalor yang diserap maupun keluar sistem.
Selama proses temperatur gas naik dari Tc ke Th dan mendapat usaha Wda .
Efisiensi
dari mesin kalor siklus Carnot :
h= W/Qh = 1 - Qc /Qh
karena
Qc /Qh = Tc /Th (buktikan)
maka
h= 1 - Tc /Th
Hukum kedua Termodinamika
Hukum kedua termodinamika terkait dengan entropi.
Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika
terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu,
mendekati nilai maksimumnya.
Hukum kedua termodinamika adalah ekspresi dari
kecenderungan yang dari waktu ke waktu, perbedaan suhu, tekanan, dan
menyeimbangkan potensi kimia dalam terisolasi sistem fisik .Dari keadaan kesetimbangan
termodinamika, hukum menyimpulkan prinsip peningkatan entropi dan menjelaskan
fenomena ireversibilitas di alam. Hukum kedua menyatakan ketidakmungkinan mesin
yang menghasilkan energi yang dapat digunakan dari energi internal melimpah
alam dengan proses yang disebut gerak abadi dari jenis yang kedua.
Hukum kedua dapat dinyatakan dengan cara tertentu,
tetapi rumusan pertama adalah dikreditkan ke ilmuwan Jerman Rudolf Clausius
.Hukum biasanya dinyatakan dalam bentuk fisik proses mustahil. Dalam termodinamika
klasik , hukum kedua adalah dasar dalil yang berlaku untuk setiap sistem yang
melibatkan terukur panas transfer, sedangkan pada termodinamika statistik ,
hukum kedua adalah konsekuensidari unitarity dalam teori kuantum . Dalam
termodinamika klasik, hukum kedua mendefinisikan konsep termodinamika entropi ,
sementara di entropi mekanika statistik didefinisikan dari teori informasi ,
yang dikenal sebagai entropi Shannon .
Arah Proses Termodinamik
- Proses termodinamik yang berlanggsung secara alami seluruhnya disebut proses ireversibel (irreversibel process). Proses tersebut berlanggsung secara spontan pada satu arah tetapi tidak pada arah sebaliknya. Contohnya kalor berpindah dari benda yang bersuhu tinggi ke benda yang bersuhu rendah.
- Proses reversibel adalah proses termodinamik yang dapat berlanggsung secara bolak-balik. Sebuah sistem yang mengalami idealisasi proses reversibel selalu mendekati keadaan kesetimbangan termodinamika antara sistem itu sendiri dan lingkungannya. Proses reversibel merupakan proses seperti-kesetimbangan(quasi equilibrium process).
Tiga Pernyataan Bagi Hukum Kedua Termodinamika
- Kalor tidak mengalir secara spontan dari dingin ke panas. (sebaliknya: dapat spontan?)
- Tidak ada mesin yang dapat mengubah kalor menjadi usaha secara utuh, (sebaliknya: dapat spontan?)
- Setiap sistem terisolasi condong menjadi acak. (sistem terbuka: dapat menumbuhkaketeraturan?)
Kalor tidak akan mengalir spontan dari benda dingin ke
benda panas
[Rudolf Clausius (1822 – 1888)]
[Rudolf Clausius (1822 – 1888)]
1.
Pada taraf molekular:
- Molekul yang bergerak lebih cepat,
akan menyebarkan energinya kepada lingkungannya
2.
Pada taraf makroskopik:
-
Perlu pasokan energi / usaha, untuk
mendinginkan sebuah benda
Anda tidak dapat membuat mesin yang sekedar mengubah
kalor menjadi usaha sepenuhnya[Kelvin
(1824 – 1907) & Planck (1858 – 1947)]
1.
Efisiensi mesin tidak dapat 100%
2.
Diperlukan tandon panas dan tandon
dingin
3.
Tandon panas menjadi sumber energi
4.
Perlu membuang kalor pada suhu yang
lebih rendah, ke tandon dingin
5.
Biasanya tandon suhu terendah =
atmosfer
Hukum II Termodinamika
1.
Jika tidak ada kerja dari
luar, panas tidak dapat merambat secara spontan dari suhu rendah ke suhu tinggi
(Clausius)
2. Proses perubahan kerja menjadi
panas merupakan proses irreversible jika tidak terjadi proses lainnya
(Thomson-Kelvin-Planck)
3. Suatu mesin tidak mungkin
bekerja dengan hanya mengambil energi dari suatu sumber suhu tinggi kemudian
membuangnya ke sumber panas tersebut untuk menghasilkan kerja abadi
(Ketidakmungkinan mesin abadi)
4. Mesin Carnot adalah salah satu
mesin reversible yang menghasilkan daya paling ideal. Mesin ideal
memiliki efisiensi maksimum yang mungkin dicapai secara teoritis






0 comments:
Speak up your mind
Tell us what you're thinking... !